Дитина, народжена з рідкісним, загрозливим життям генетичного захворювання, процвітає після отримання інноваційного, персоналізованого лікування генів.
Експериментальна терапія, створена спеціально для свого стану, фіксується на хвилину, але вирішальна помилка в своєму генетичному коді, що пропонує надію на інших з тими ж рідкісними захворюваннями.
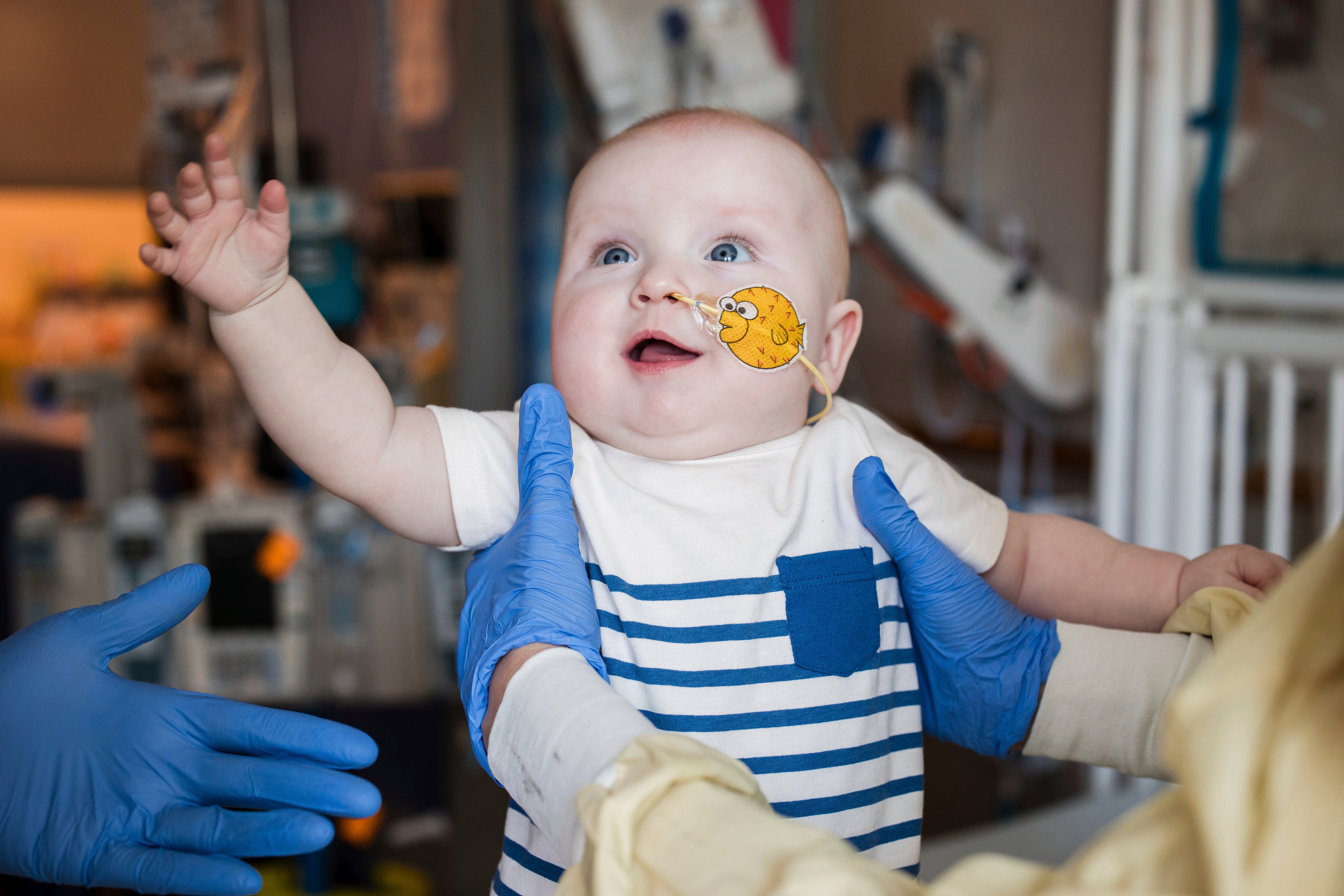
Дитину, KJ Muldoon з Clifton Heights, штат Пенсильванія, діагностували незабаром після народження з важким CPS1.
Цей стан, за підрахунками, близько одного на мільйон дітей, запобігає ефективному видаленню організму, що призводить до потенційно токсичної будівлі в крові.
Хоча трансплантація печінки для деяких може бути рішенням, це інноваційне лікування генів, що редагують новий шлях надії.
Дослідження, опубліковане в Медичному журналі Нової Англії, детально описує випадок KJ та підкреслює потенціал цієї технології.
Доктор Кіран Мунунуру, експерт з редагування генів університету Пенсільванії та співавтору дослідження, вітав лікування як “перший крок до використання генів для редагування лікування для широкого спектру рідкісних генетичних розладів, для яких наразі немає певних методів лікування”.
Випадок KJ – це значний прогрес у персоналізованій медицині, що демонструє потенціал для адаптації лікування до окремих генетичних профілів.
Незважаючи на те, що горизонт залишається широкою доступністю такої персоналізованої терапії, ця історія успіху пропонує маяк надії на мільйони, які страждали від рідкісних генетичних станів, які часто не помічають основних медичних досягнень.
KJ – один із перших, хто отримав користь від цього вдосконаленого підходу, прокладаючи шлях до редагування майбутніх генів при лікуванні більш широкого спектру рідкісних захворювань.
Знаючи шанси К. Дж., Батьків Кайла та Ніколь Мальдун, обидва 34 роки, переживають, що вони можуть його втратити.
“Ми, як відомо, зважили всі варіанти, задавали всі питання або про трансплантацію печінки, яка є інвазивною, або щось таке, що ніколи раніше не робилося”, – сказала Ніколь.
“Ми молилися, ми розмовляли з людьми, ми зібрали інформацію, і врешті -решт ми вирішили, що саме так ми їдемо”, – додав її чоловік.
Протягом шести місяців команда дитячої лікарні Філадельфії та Пенн Медицини разом зі своїми партнерами створила терапію, розроблену для виправлення несправного гена KJ. Вони використовували CRISPR, інструмент редагування генів, який виграли його винахідники Нобелівської премії в 2020 році. Замість того, щоб різати нитки ДНК, як і перші підходи CRISPR, лікарі застосовували метод, який перетворює мутовану «букву» ДНК, також відомий як основа, до потрібного типу. Відомий як “основне редагування”, це знижує ризик ненавмисних генетичних змін.
На думку дослідника генетичної терапії Senthil Bhoopalan у дослідницькій лікарні Сент -Юди, в Мемфісі, який не брав участі у дослідженні, “дуже цікаво” команда створила терапію. “Це дійсно встановлює темп і стандарт для таких підходів”.
У лютому KJ отримав свою першу інфузію IV з терапією редагування генів, що постачаються через крихітні жирові краплі, звані ліпідними наночастинками, які займаються клітинами печінки.
Поки цей день у кімнаті гуде від хвилювання, “він все це спав”, згадує автор досліджень доктора Ребекки Аренас-Ніклас, експерта з генетичної терапії в CHOP.

Після наступних доз у березні та квітні KJ зміг їсти більш нормально та добре відкрити від захворювань, наприклад, застуду, яке може напружувати організм і посилити симптоми CPS1. 9,5-місячного віку також приймає менше наркотиків.
З огляду на його поганий прогноз раніше: “Кожен раз, коли ми бачимо навіть найменшу віху, з якою він зустрічається – як маленька хвиля чи кочення – це великий момент для нас”, – сказала його мати.
Однак дослідники попереджають, що минуло лише кілька місяців. Їм потрібно буде спостерігати за ним роками.
“Ми все ще дуже на ранніх етапах розуміння того, що цей ліки для KJ може зробити”,-сказав Герсе-Ніклас. “Але кожен день він показує нам ознаки, які росте і процвітають”.
Дослідники сподіваються, що те, що вони дізнаються від KJ, допоможе іншим пацієнтам з рідкісним захворюванням.
Генна терапія, яка може бути надзвичайно дорогою для розвитку, зазвичай спрямована на більш поширені розлади частоти з простих фінансових причин: більше пацієнтів означають потенційно більше продажів, що може допомогти оплатити витрати на розвиток та отримати великий прибуток. Наприклад, перша терапія CRISPR, затверджена американськими продуктами та контролем наркотиків, лікує серпоподібну хворобу клітин, хворобливе захворювання крові, що впливає на мільйони по всьому світу.
Мунунуру заявив, що робота його команди, частково фінансується Національними установами охорони здоров’я, показала, що створення лікування користувачів не повинно бути надмірно дорогим. За його словами, вартість була далеко від 800 000 доларів за середню трансплантацію печінки та пов’язана з цим допомога.
“Коли ми стаємо кращими і краще виконувати ці методи лікування і ще більше скорочують час, набуть чинності масштабів, і я очікую, що витрати зменшаться”, – сказав Мусунуру.
За словами Бхупалана, вченим також не потрібно переробляти всю початкову роботу щоразу, коли вони створюють індивідуальну терапію, тому це дослідження “підготує” до лікування інших рідкісних станів.
Карлос Мораес, професор неврології в університеті Майамі, який не був пов’язаний з дослідженням, сказав, що такі дослідження відкривають двері для отримання більшого успіху.
“Як тільки хтось приходить з таким проривом, інші команди не потребуватимуть часу”, щоб застосувати уроки та рухатися вперед, сказав він. “Є бар’єри, але я прогнозую, що вони будуть перетинатись у наступні п’ять -10 років. Тоді все поле рухається як блок, тому що ми в основному готові”.





